La scoperta delle auxine
Nell'articolo precedente (Fitormoni. Cenni storici ed importanza fisiologica) è stata trattata brevemente la storia degli ormoni vegetali,
accennando qualcosa sulla loro scoperta e sulla loro funzione. In particolare sono stati trattati i due fitormoni etilene ed acido abscissico (ABA) più comunemente noti come ormoni della senescenza.
In questo articolo invece inizieremo a trattare singolarmente gli ormoni della giovinezza e cominceremo questo percorso partendo dalle auxine.
L’auxina fu il primo ormone ad essere stato scoperto ed il responsabile di questa rivelazione altri non fu che Charles Darwin il quale intuì la presenza nell’apice vegetale di una o più molecole chimiche a cui erano imputabili i fenomeni di fototropismo (spostamento degli apici verso una fonte luminosa) osservati nei vegetali.
Parte dei suoi esperimenti condotti su questo argomento furono pubblicati nel 1881 in un libro intitolato The Power of Movement in Plants. Nel 1880 Darwin padre e figlio fecero uno studio incentrato sulla tendenza di piante di Phalaris canariensis a piegarsi verso una fonte luminosa unidirezionale.
Essi notarono che coprendo l’apice della pianta, il germoglio non si inclinava verso la luce mentre la rimozione della copertura comportava una rapida curvatura della porzione immediatamente sottostante l’apice meristematico verso la fonte luminosa.
Tali risultati permisero ai due Darwin di constatare che la parte terminale dell’apice influenzava in qualche modo l'accrescimento cellulare ed ipotizzarono che, nella regione apicale, fosse prodotta una qualche molecola chimica che. migrando dall’alto verso il basso. andava ad influenzare la distensione cellulare delle porzioni sottostanti inducendo le cellule a distendersi in maniera diversa.
Ci vollero circa trenta anni prima che le osservazioni dei Darwin venissero confermate. Questo fu possibile grazie al botanico danese Peter Boysen-Jensen il quale riuscì a dimostrare che la curvatura dell’apice era probabilmente dovuta ad una sostanza chimica, che causava una maggiore distensione delle cellule poste sul lato della pianta rimasto al buio rispetto a quelle che posizionate sulla porzione illuminata.
Egli asportò la parte apicale del germoglio e la espose alla luce (come osservato da Darwin la restante parte perse lo stimolo foto tropico) successivamente posizionò un blocchetto di gelatina sul moncone e riappoggiò su questa la porzione di apice asportata e quando riespose alla luce la piantina questa ricominciò a curvarsi. I dati così ottenuti gli permisero di dimostrare la presenza di una sostanza chimica prodotta dall’apice vegetale che spostandosi besipitamente modificava la distensione cellulare della regione sottostante causando la tipica curvatura.
Negli anni successivi moltissimi studi confermarono questa teoria ma fu solo nel 1930 che questa sostanza, soprannominata da Went “Auxina”, venne chimicamente identificata come l'acido 3-indolacetico (IAA). Negli anni successivi questa molecola venne rinvenuta in un elevato numero di piante ed ancora oggi è considerata l’auxina più significativa dal punto di vista fisiologico.
Infatti è bene ricordare che l’IAA sebbene sia considerato l’auxina più importante, è stato rinvenuto in un numero ristretto di specie vegetali e che le attività auxiniche osservate sulla totalità dei vegetali sono dovute a molte altre molecole sempre derivate dall’acido indolacetico o correlate con questo (ecco perché non si parla mai di auxina ma di auxine).
L’auxina fu il primo ormone ad essere stato scoperto ed il responsabile di questa rivelazione altri non fu che Charles Darwin il quale intuì la presenza nell’apice vegetale di una o più molecole chimiche a cui erano imputabili i fenomeni di fototropismo (spostamento degli apici verso una fonte luminosa) osservati nei vegetali.
Parte dei suoi esperimenti condotti su questo argomento furono pubblicati nel 1881 in un libro intitolato The Power of Movement in Plants. Nel 1880 Darwin padre e figlio fecero uno studio incentrato sulla tendenza di piante di Phalaris canariensis a piegarsi verso una fonte luminosa unidirezionale.
Essi notarono che coprendo l’apice della pianta, il germoglio non si inclinava verso la luce mentre la rimozione della copertura comportava una rapida curvatura della porzione immediatamente sottostante l’apice meristematico verso la fonte luminosa.
Tali risultati permisero ai due Darwin di constatare che la parte terminale dell’apice influenzava in qualche modo l'accrescimento cellulare ed ipotizzarono che, nella regione apicale, fosse prodotta una qualche molecola chimica che. migrando dall’alto verso il basso. andava ad influenzare la distensione cellulare delle porzioni sottostanti inducendo le cellule a distendersi in maniera diversa.
Ci vollero circa trenta anni prima che le osservazioni dei Darwin venissero confermate. Questo fu possibile grazie al botanico danese Peter Boysen-Jensen il quale riuscì a dimostrare che la curvatura dell’apice era probabilmente dovuta ad una sostanza chimica, che causava una maggiore distensione delle cellule poste sul lato della pianta rimasto al buio rispetto a quelle che posizionate sulla porzione illuminata.
Egli asportò la parte apicale del germoglio e la espose alla luce (come osservato da Darwin la restante parte perse lo stimolo foto tropico) successivamente posizionò un blocchetto di gelatina sul moncone e riappoggiò su questa la porzione di apice asportata e quando riespose alla luce la piantina questa ricominciò a curvarsi. I dati così ottenuti gli permisero di dimostrare la presenza di una sostanza chimica prodotta dall’apice vegetale che spostandosi besipitamente modificava la distensione cellulare della regione sottostante causando la tipica curvatura.
Negli anni successivi moltissimi studi confermarono questa teoria ma fu solo nel 1930 che questa sostanza, soprannominata da Went “Auxina”, venne chimicamente identificata come l'acido 3-indolacetico (IAA). Negli anni successivi questa molecola venne rinvenuta in un elevato numero di piante ed ancora oggi è considerata l’auxina più significativa dal punto di vista fisiologico.
Infatti è bene ricordare che l’IAA sebbene sia considerato l’auxina più importante, è stato rinvenuto in un numero ristretto di specie vegetali e che le attività auxiniche osservate sulla totalità dei vegetali sono dovute a molte altre molecole sempre derivate dall’acido indolacetico o correlate con questo (ecco perché non si parla mai di auxina ma di auxine).
Via metabolica e trasporto
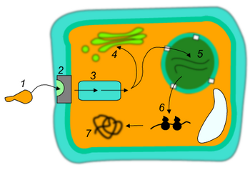
Il metabolismo dell’auxina comprende la sintesi della molecola, il trasporto di questa ai siti di utilizzo, la risposta allo stimolo seguita dalla degradazione e la successiva disattivazione dell’IAA. Questi processi permettono di controllare le concentrazioni di auxina all’interno della pianta, influendo così sui processi fisiologici che sono sotto il controllo di questo ormone. Il processo di degradazione e di disattivazione dell’auxina è un processo fondamentale dal punto di vista fisiologico ma soprattutto dal punto di vista economico poiché l’efficacia delle auxine sintetiche sta proprio nell’incapacità della pianta di degradarle. Infatti, mentre le auxine naturali vengono riconosciute e degradate dalla pianta se ritenute superflue e non funzionali in un preciso momento, quelle sintetiche essendo poco degradabili permettono di spingere la pianta a fare ciò che noi vogliamo in un preciso momento indipendentemente da ciò che ne pensa la pianta.
Inoltre su questo principio si basa la maggior parte dei diserbanti ad attività auxinica come il 2,4 D che a bassissime concentrazioni viene ampiamente utilizzato come radicante per talee mentre ad alte concentrazioni svolge l’attività di erbicida sistemico specialmente per specie arboree ed erbacee a foglia larga. Sebbene la biosintesi dell’IAA sia un meccanismo ancora incerto, ci sono prove concrete che dimostrano che nella maggior parte dei casi tale molecola sia sintetizzata a partire dall’amminoacido triptofano. I siti primari di sintesi delle auxine sono tutti quei tessuti a rapida divisione cellulare come gli apici vegetativi apicali, le giovani foglie, gli embrioni ed i frutti in via di sviluppo e, sebbene in minori quantità, le auxine possono essere prodotte anche negli apici radicali e nelle foglie mature. Il trasporto delle auxine all’interno della pianta è definito trasporto polare perché avviene in una sola direzione, cosicché le auxine prodotte dagli organi apicali si spostano lungo il floema in direzione basipeta per poi risalire, una volta giunte agli organi radicali, in direzione acropeta sia per via xilematica che attraverso un trasporto cellulare (da cellula a cellula).
Effetti fisiologici
Una volta parlato della storia, della sintesi e del trasporto delle auxine, passeremo a trattare le funzioni fisiologiche. L’auxina esercita un’ampia gamma di effetti sull’accrescimento e sulla morfogenesi vegetale. Fra questi ricordiamo:
Con il termine di “dominanza apicale” si intende il fenomeno secondo il quale la gemma apicale in accrescimento inibisce, in diversa misura, l’accrescimento delle gemme laterali (ascellari). Il fenomeno, sebbene tuttora argomento di dibattito scientifico, sembra sia dovuto al fatto che l’auxina prodotta dall’apice in crescita determina un flusso preferenziale verso l’apice di acqua , nutrienti, e citochinine (ormoni di origine radicale) deprivando le gemme sottostanti di tali sostanze.
La spiegazione è abbastanza plausibile, visto che è stato ampiamente dimostrato che i tessuti in accrescimento fungono da “sink” (pozzo ossia organo in cui vengono preferenzialmente stoccati o indirizzati gli elementi nutritivi e di riserva) richiamando il flusso dei nutrienti.
Un altro fattore fondamentale a cui è imputabile il fenomeno della dominanza apicale è il rapporto auxine citochinine ed acido abscissico. Un apice in crescita e le giovani foglie in espansione causano un elevato flusso in senso basipeto di auxine ed acido abscissico (la cui produzione è stimolata dalle auxine) con un gradiente di concentrazione che risulta essere maggiore nella parte apicale e che decresce lungo l’asse.
Le citochinine, che invece sono prodotte dalla radice, fanno il percorso inverso creando un gradiente di concentrazione che risulta essere maggiore nelle parti basali e che decresce salendo lungo l’asse. Laddove il rapporto auxine/citochinine è alto (maggiore presenza di auxine) si osserva un’inibizione delle gemme, quando il rapporto invece è basso (maggiore presenza di citochinine) si osserva una riduzione di tale dominanza.
Questo è il motivo per cui, man mano che l’apice si accresce, le gemme disposte alla base del ramo iniziano ad accrescersi. Come risaputo, la rimozione dell’apice meristematico, durante la stagione di accrescimento, elimina il fenomeno di dominanza apicale. Dopo l’asportazione dell’apice, la fonte principale di auxine inizierà a mancare (con lei anche la produzione di acido abscissico che manteneva le gemme dormienti) ed aumenterà la concentrazione del flusso di citochinine con il conseguente risveglio delle gemme all’interno delle quali inizieranno tutti quei processi di divisione e distensione cellulare che porteranno alla formazione dei rami laterali. In questo caso tutti gli apici meristematici dei nuovi germogli fungeranno da nuove fonti di auxine riproponendo il fenomeno di dominanza apicale.
Avvenuto ciò, ogni nuovo apice avrà una via preferenziale per il richiamo dei nutrienti che però verranno equamente ripartiti e quindi cresceranno in maniera meno vigorosa se comparati all’accrescimento del ramo principale prima della capitozzatura. L’asportazione dell’apice tardiva, verso la fine del periodo di accrescimento vegetativo, non sarà più sufficiente a determinare l’accrescimento delle gemme laterali e per ottenere questo risultato sarà necessario asportare anche le foglie. In questa fase siamo in presenza di un’inibizione di tipo correlativo, durante la quale al ruolo dell’apice vegetativo si è progressivamente aggiunto quello delle foglie adulte che sebbene in basse quantità sono anch’esse produttrici di auxine. Il meccanismo di questa inibizione è tuttora meno chiaro di quello della dominanza apicale.
Effetti fisiologici
Una volta parlato della storia, della sintesi e del trasporto delle auxine, passeremo a trattare le funzioni fisiologiche. L’auxina esercita un’ampia gamma di effetti sull’accrescimento e sulla morfogenesi vegetale. Fra questi ricordiamo:
- La dominanza apicale;
- L’accrescimento per distensione cellulare;
- Risposte tropiche (fototropismo e gravi tropismo);
- Stimolazione della formazione di radici laterali;
- L’inibizione dell’abscissione fogliare;
- Accrescimento dei frutti e formazione di frutti apireni.
Con il termine di “dominanza apicale” si intende il fenomeno secondo il quale la gemma apicale in accrescimento inibisce, in diversa misura, l’accrescimento delle gemme laterali (ascellari). Il fenomeno, sebbene tuttora argomento di dibattito scientifico, sembra sia dovuto al fatto che l’auxina prodotta dall’apice in crescita determina un flusso preferenziale verso l’apice di acqua , nutrienti, e citochinine (ormoni di origine radicale) deprivando le gemme sottostanti di tali sostanze.
La spiegazione è abbastanza plausibile, visto che è stato ampiamente dimostrato che i tessuti in accrescimento fungono da “sink” (pozzo ossia organo in cui vengono preferenzialmente stoccati o indirizzati gli elementi nutritivi e di riserva) richiamando il flusso dei nutrienti.
Un altro fattore fondamentale a cui è imputabile il fenomeno della dominanza apicale è il rapporto auxine citochinine ed acido abscissico. Un apice in crescita e le giovani foglie in espansione causano un elevato flusso in senso basipeto di auxine ed acido abscissico (la cui produzione è stimolata dalle auxine) con un gradiente di concentrazione che risulta essere maggiore nella parte apicale e che decresce lungo l’asse.
Le citochinine, che invece sono prodotte dalla radice, fanno il percorso inverso creando un gradiente di concentrazione che risulta essere maggiore nelle parti basali e che decresce salendo lungo l’asse. Laddove il rapporto auxine/citochinine è alto (maggiore presenza di auxine) si osserva un’inibizione delle gemme, quando il rapporto invece è basso (maggiore presenza di citochinine) si osserva una riduzione di tale dominanza.
Questo è il motivo per cui, man mano che l’apice si accresce, le gemme disposte alla base del ramo iniziano ad accrescersi. Come risaputo, la rimozione dell’apice meristematico, durante la stagione di accrescimento, elimina il fenomeno di dominanza apicale. Dopo l’asportazione dell’apice, la fonte principale di auxine inizierà a mancare (con lei anche la produzione di acido abscissico che manteneva le gemme dormienti) ed aumenterà la concentrazione del flusso di citochinine con il conseguente risveglio delle gemme all’interno delle quali inizieranno tutti quei processi di divisione e distensione cellulare che porteranno alla formazione dei rami laterali. In questo caso tutti gli apici meristematici dei nuovi germogli fungeranno da nuove fonti di auxine riproponendo il fenomeno di dominanza apicale.
Avvenuto ciò, ogni nuovo apice avrà una via preferenziale per il richiamo dei nutrienti che però verranno equamente ripartiti e quindi cresceranno in maniera meno vigorosa se comparati all’accrescimento del ramo principale prima della capitozzatura. L’asportazione dell’apice tardiva, verso la fine del periodo di accrescimento vegetativo, non sarà più sufficiente a determinare l’accrescimento delle gemme laterali e per ottenere questo risultato sarà necessario asportare anche le foglie. In questa fase siamo in presenza di un’inibizione di tipo correlativo, durante la quale al ruolo dell’apice vegetativo si è progressivamente aggiunto quello delle foglie adulte che sebbene in basse quantità sono anch’esse produttrici di auxine. Il meccanismo di questa inibizione è tuttora meno chiaro di quello della dominanza apicale.
Accrescimento per distensione cellulare (accrescimento acido)
Per quanto riguarda il processo di accrescimento per distensione cellulare è stato notato che l’auxina può avere una duplice funzione. Studi scientifici hanno dimostrato che a bassissime concentrazioni (0,1 µM) il processo di distensione cellulare è favorito. Mentre, concentrazioni più alte di auxina portano alla produzione dell’ormone vegetale etilene, il quale sopprime la crescita per distensione. Il processo di accrescimento per distensione cellulare imputato all’auxina prende il nome di accrescimento acido. Tale nome è dovuto al fatto che è stato dimostrato che la presenza di auxina al’interno della cellula porta all’estrusione, nell’ambiente esterno alla cellula, di ioni idrogeno (H+) che acidificando l’ambiente esterno portano ad un rilassamento della parete cellulare.
Tale rilassamento porta ad un abbassamento del potenziale idrico interno alla cellula e quindi ad un successivo assorbimento di acqua che gonfia la cellula come un palloncino distendendola e facendola ingrandire. A questo punto la concentrazione di auxina interna diminuirà a causa del maggior quantitativo di acqua e cesserà l’estrusione degli ioni idrogeno, l’ambiente esterno alla cellula diventerà meno acido e la parete cellulare potrà ripristinare la sua struttura iniziale e la sua rigidità, solo che sarà molto più grande di prima a causa della distensione dovuta all’entrata di acqua.
Risposte tropiche (fototropismo e gravitropismo)
Con il termine tropismo si intende una risposta a uno stimolo esterno che determina la curvatura o il movimento di un organismo stimolato in una particolare direzione (dal greco tropos, “movimento”). Se tale movimento avviene verso la sorgente dello stimolo, si parla di tropismo positivo, mentre nel caso contrario si parla di tropismo negativo. Nel caso delle piante, all’interno dello stesso organismo, sono presenti due distinti tipi di tropismi ed entrambi sono governati dalla distribuzione auxinica. Infatti le auxine sono in grado di mediare gli effetti della luce e della gravità sull’accrescimento vegetale facendo accrescere la parte apicale verso le fonti luminose, mentre la parte radicale verso il centro della terra. Il meccanismo che sottendono a questi processi sono molto complessi e multifattoriali e quindi momentaneamente non verranno trattati.
Stimolazione della formazione di radici laterali
Sul controllo dell’accrescimento della radice per distensione non si sa ancora molto poiché i risultati sull’accrescimento radicale indotto dall’auxina sono contradditori. Ciò che però è ampiamente dimostrato è che sebbene la crescita della radice primaria per distensione cellulare è inibita da concentrazione di auxina superiori a 0,08 µM, l'iniziazione di radici laterali ed avventizie è stimolata da alte concentrazioni di questo ormone. Tale effetto sta alla base della propagazione di piante per talea.
Inibizione dell’abscissione fogliare
L’abscissione nelle piante è quel fenomeno che porta alla caduta delle foglie, dei fiori e dei frutti. È ampiamente risaputo che l’auxina ritarda i primi stadi di abscissione fogliare e ne promuove indirettamente i successivi. Nelle foglie giovani in pieno accrescimento, le concentrazioni di auxine sono molto alte. Una volta avvenuta la completa distensione della lamina fogliare le concentrazioni di questo ormone diminuiscono progressivamente fino a diventare relativamente basse nelle foglie senescenti. Quando presente in grandi quantità l’auxina funge da protettivo nei confronti dell’etilene (ormone principale nell’abscissione fogliare). La riduzione di auxina nelle foglie senescenti non solo diminuisce la sua attività protettiva ma stimola anche una maggiore produzione di etilene che prende il sopravvento e porta alla successiva abscissione.
Regolazione dello sviluppo dei frutti
Sebbene di scarso interesse dal punto di vista bonsaistico è interessante sapere che anche sulla regolazione dell’accrescimento dei frutti è stato dimostrato il coinvolgimento diretto delle auxine. Queste vengono prodotte in grande quantità dall’embrione in accrescimento trasformando i frutticini in “Sink” all’interno dei quali verranno riversati preferenzialmente acqua e nutrienti. Infatti, durante l’accrescimento dei frutti si osserva un blocco vegetativo e ad una graduale perdita della dominanza apicale dovuta proprio all’elevata produzione di auxina dei frutti in accrescimento, che diventano per la pianta gli organi principali di accumulo.
Applicazioni commerciali
In campo agronomico, orticolo e vivaistico l’appiclazione di auxine esogene è ampiamente utilizzata da circa 50 anni. Fra le applicazioni più importanti ricordiamo quelle atte a favorire l’allegaggione e l’ingrossamento dei frutti. La lotta alle erbe infestanti (produzione di erbicidi auxinici). E “dulcis in fundo” la radicazione di talee per la propagazione vegetativa. Su quest’ultimo argomento ci soffermeremo particolarmente visto l’importante interesse applicativo.
Risposte tropiche (fototropismo e gravitropismo)
Con il termine tropismo si intende una risposta a uno stimolo esterno che determina la curvatura o il movimento di un organismo stimolato in una particolare direzione (dal greco tropos, “movimento”). Se tale movimento avviene verso la sorgente dello stimolo, si parla di tropismo positivo, mentre nel caso contrario si parla di tropismo negativo. Nel caso delle piante, all’interno dello stesso organismo, sono presenti due distinti tipi di tropismi ed entrambi sono governati dalla distribuzione auxinica. Infatti le auxine sono in grado di mediare gli effetti della luce e della gravità sull’accrescimento vegetale facendo accrescere la parte apicale verso le fonti luminose, mentre la parte radicale verso il centro della terra. Il meccanismo che sottendono a questi processi sono molto complessi e multifattoriali e quindi momentaneamente non verranno trattati.
Stimolazione della formazione di radici laterali
Sul controllo dell’accrescimento della radice per distensione non si sa ancora molto poiché i risultati sull’accrescimento radicale indotto dall’auxina sono contradditori. Ciò che però è ampiamente dimostrato è che sebbene la crescita della radice primaria per distensione cellulare è inibita da concentrazione di auxina superiori a 0,08 µM, l'iniziazione di radici laterali ed avventizie è stimolata da alte concentrazioni di questo ormone. Tale effetto sta alla base della propagazione di piante per talea.
Inibizione dell’abscissione fogliare
L’abscissione nelle piante è quel fenomeno che porta alla caduta delle foglie, dei fiori e dei frutti. È ampiamente risaputo che l’auxina ritarda i primi stadi di abscissione fogliare e ne promuove indirettamente i successivi. Nelle foglie giovani in pieno accrescimento, le concentrazioni di auxine sono molto alte. Una volta avvenuta la completa distensione della lamina fogliare le concentrazioni di questo ormone diminuiscono progressivamente fino a diventare relativamente basse nelle foglie senescenti. Quando presente in grandi quantità l’auxina funge da protettivo nei confronti dell’etilene (ormone principale nell’abscissione fogliare). La riduzione di auxina nelle foglie senescenti non solo diminuisce la sua attività protettiva ma stimola anche una maggiore produzione di etilene che prende il sopravvento e porta alla successiva abscissione.
Regolazione dello sviluppo dei frutti
Sebbene di scarso interesse dal punto di vista bonsaistico è interessante sapere che anche sulla regolazione dell’accrescimento dei frutti è stato dimostrato il coinvolgimento diretto delle auxine. Queste vengono prodotte in grande quantità dall’embrione in accrescimento trasformando i frutticini in “Sink” all’interno dei quali verranno riversati preferenzialmente acqua e nutrienti. Infatti, durante l’accrescimento dei frutti si osserva un blocco vegetativo e ad una graduale perdita della dominanza apicale dovuta proprio all’elevata produzione di auxina dei frutti in accrescimento, che diventano per la pianta gli organi principali di accumulo.
Applicazioni commerciali
In campo agronomico, orticolo e vivaistico l’appiclazione di auxine esogene è ampiamente utilizzata da circa 50 anni. Fra le applicazioni più importanti ricordiamo quelle atte a favorire l’allegaggione e l’ingrossamento dei frutti. La lotta alle erbe infestanti (produzione di erbicidi auxinici). E “dulcis in fundo” la radicazione di talee per la propagazione vegetativa. Su quest’ultimo argomento ci soffermeremo particolarmente visto l’importante interesse applicativo.
Applicazione delle auxine per la propagazione vegetativa.
Il fine del trattamento auxinico su talea è quello di favorire l’inizializzazione delle radici, ottenere una radicazione più uniforme ed incrementare la percentuale di successo in termini di radicazione. Ovviamente l’uso di queste sostanze è semplicemente un aiuto supplementare il che non esclude l’osservazione delle buone norme di propagazione relative ad un’accurata gestione dell’acqua, della temperatura, della luce ed infine la scelta del materiale adatto. Su quest’ultimo aspetto è necessario precisare che non esiste una norma specifica da seguire nella scelta del materiale, ma solo gli studi precedenti e l’esperienza permettono di stabilire quale sia il miglior tipo di materiale di partenza in base alla specie da propagare. Ad esempio in alcuni casi è stato notato che le talee ottenute da rami più vicini al colletto radicano più facilmente di quelle prese dalle zone più alte. Inoltre, mentre in alcune specie vegetali più giovane è la talea e maggiori sono le possibilità di successo, in altre specie come ad esempio l’ulivo la situazione è all’inverso. Da quanto è possibile notare non esiste una regola unica per il reperimento del materiale di partenza.
< Talea di Gardenia jasminoides
Tipologie di talee
Sebbene un'ampia gamma di piante radica molto facilmente, per cui non è importante il tipo di talea che si sceglie di fare è opportuni precisare che ne esistono di differenti tipologie. Infatti, le talee possono essere raggruppate in: talee erbacee, semilegnose e legnose, di punta, di fusto, di ramo, di foglia, di radice e tallonate. Le talee erbacee sono quelle ottenute dai rami non lignificati ed in pieno accrescimento vegetativo. Questo tipo di talee viene generalmente utilizzato sia su piante decidue che sempreverdi. Le controindicazioni riguardanti l’utilizzo di questi tipi di talea sta nel fatto che necessitano di un ambiente molto umido onde evitare un rapido disseccamento. Le talee semilegnose di piante sempreverdi vengono invece fatte in stagione più avanzata (generalmente Settembre). In questo caso il ramo impiegato si trova in una fase intermedia di maturazione e per questo viene descritto anche come legno semi-maturo o agostato. Per quanto riguarda invece le talee di tipo legnoso, queste vengono fatte in primavera e con questo metodo possono essere propagate sia specie decidue che sempreverdi. Ovviamente, maggiore è la durezza del materiale e maggiore sarà il tempo necessario per l’emissione delle radici ma di contro si riduce la sensibilità della talea all’ambiente di radicazione. Fra le tipologie di talea di più facile radicazione troviamo le talee di apice vegetativo (circa 10 cm) anche dette “talee di punta”. La facilità con cui queste radicano sta nel fatto dell’elevata presenza di auxina endogena che viene prodotta costantemente dall’apice anche dopo essere stato espiantato dalla pianta madre. Questi tipi di talea, se protette dal disseccamento, possono portare alla formazione di un buon apparato radicale già dopo 1-2 settimane. Un’altra tipologia di talea che permette la radicazione di piante più problematiche è quella tallonata. Queste talee prevedono alla base la presenza di una piccola sezione (circa 3-5 mm) del ramo dell'anno precedente. La presenza di questo tallone garantisce la possibilità di contenere livelli più alti di ormone radicante e riduce la probabilità che la base della talea vada incontro a marciume. Una pianta che si presta molto a questo tipo di talea è la Camellia sp..
Ambiente di propagazione
La cura data alle talee durante la fase critica di formazione delle radici è altrettanto importante della scelta e della preparazione del tipo di talea. Il fine di tenere in vita le talee fino alla radicazione e quindi all’auto-sostentamento ha spinto i propagatori vegetali a sviluppare molti modi creativi per fornire un ambiente favorevole alla radicazione. Luce, temperatura e umidità sono di solito i fattori ambientali maggiormente manipolati. Conoscere bene la specie su cui si sta operando è importantissimo poiché permette di determinare la preparazione dell'ambiente di propagazione. Un elevato tasso di umidità intorno alle foglie ed agli steli di talee erbacee e semilegnose di conifere e latifoglie permette di evitare il loro disseccamento e permette lo svolgimento delle normali funzioni delle piante quali fotosintesi e respirazione evitando che la pianta entri in stress mentre le nuove radici sono in formazione. Nella maggior parte dei sistemi di propagazione, si cerca di fare in modo che ci sia nel substrato di radicazione un giusto equilibrio tra aria tellurica ed umidità per consentire lo sviluppo di radici sane e per evitare eventuali marciumi. Inoltre, è stato notato che i processi biochimichi e fisiologici che portano alla radicazione delle talee si accelerano se a queste viene fornito un terreno di qualche grado più caldo rispetto alle temperature dell’aria.
Tipologie di auxine sintetiche
Prima di iniziare a parlare degli ormoni di sintesi e della loro applicazione è bene precisare che l’impiego di ormoni a concentrazioni troppo alte può essere più controproducente che il non utilizzarli affatto. I tessuti dello stelo possono essere uccisi da concentrazioni troppo alte di ormoni. Inoltre, la base della talea, una volta trattata, può anche andare incontro a necrosi dovute ad un impiego eccessivo di ormoni di sintesi e nel caso in cui la superficie di taglio dovesse necrotizzarsi non vi sarà alcun radicamento (la necrotizzazione del taglio può essere anche dovuta ad un eccesso di umidità nel substrato). Gli ormoni sintetici maggiormente utilizzati per stimolare la produzione di radici avventizie nelle talee sono l’acido indolbutirrico (IBA) e l’acido naftalenacetico (NAA). Fra i due, l’IBA è il prodotto migliore poiché promuovere la radicazione di una vastissima gamma di specie e perché nel caso in cui si dovesse eccedere con la concentrazione risulta meno fitotossico del NAA. Queste due molecole sono acquistabili in commercio sia in formulati dispersi in talco che in soluzione acquosa da diluire ulteriormente in acqua per essere portati alla concentrazione richiesta.
Metodologie di applicazione
Applicazioni polverulente
Le concentrazioni ormonali da impiegare durante la propagazione per talea devono variare in base alla tipologia di talea che si sta cercando di eseguire. Per le talee di tipo legnoso verranno utilizzate delle concentrazioni lievemente più alte di quelle impiegate per le talee di tipo erbaceo o semilegnoso. Una delle tecniche impiegate per migliorare i risultati di radicazione comprendono l’immersione della base della talea in una soluzione al 50% di acetone o di etanolo puro prima di applicare l’IBA in formato polverulento. Una volta avvenuto il trattamento ormonale è buona norma allocare la talea nel substrato di propagazione cercando di evitare che la polvere alla base delle talee venga portata via durante l’inserimento di questa nel substrato. A tal fine è preferibile fare un buco nel substrato appoggiarvi dentro la talea e rincalzarle accuratamente. Queste attenzioni vanno eseguite poiché sebbene i formulati in talco risultano essere facili da impiegare la loro forma polverulenta comporta un’elevata variabilità nella quantità di ormone che raggiunge la talea. Questo è dovuto sia alla difficoltà di adesione della polvere che alla conformazione dell’epidermide la quale può essere liscia o irregolare.
Applicazione attraverso soluzioni diluite
Un’altra tecnica impiegata per il taleaggio è quella di immergere per 24 ore, prima di inserirle nel substrato di radicazione, la parte basale della talea in una soluzione diluita di auxine [0,02 g/L (20 ppm) per le specie che radicano facilmente, 0,2 g/L (200 ppm) per quelle più ostiche]. Durante la fase di ammollo le talee devono essere mantenute in un luogo fresco (± 20°C) ed ombreggiato.
Applicazioni di soluzioni concentrate
Il metodo dell’immersione rapida in soluzione concentrata è il metodo più rapido ed efficace da impiegare per la riproduzione di piante da talee. Le soluzioni da impiegare devono essere molto concentrate (da 0,5 ad 1 grammo/litro) e devono essere preparate in una soluzione composta da una soluzione Etanolo:Acqua in rapporto 1:1. Una volta preparata la soluzione la base della talea (preferibilmente la sola superficie di taglio) vi deve essere immersa all’interno della soluzione ormonale per un periodo variabile che va dai 3 ai 10 secondi in base al tipo di talea (di meno per le erbacee di più per semi-legnose e legnose) e di specie trattata. Le talee così trattate possono essere piantate direttamente nel substrato senza particolari attenzioni. Con questo metodo si è sicuri della penetrazione uniforme degli ormoni all’interno dei tessuti vegetali ed inoltre ci sarà una ridotta influenza dei fattori ambientali sul loro assorbimento. La soluzione idroalcolica una volta preparata può essere utilizzata più e più volte per più e più giorni fino al completo esaurimento. L’unica precauzione da prendere è quella di assicurarsi di chiudere ermeticamente il contenitore per evitare l’evaporazione dell’alcool e quindi la successiva concentrazione degli ormoni. Nel caso in cui si dovessero osservare dei fenomeni di fitotossicità quali l’inibizione dello sviluppo delle gemme, la necrotizzazione del fusto o l’ingiallimento fogliare, potrebbe voler significare che sono state utilizzate concentrazioni ormonali troppo alte. Se la concentrazione ormonale utilizzata è corretta si dovrebbe invece osservare in breve tempo un lieve ingrossamento della base della talea dovuta alla produzione di callo.
La soluzione concentrata al 50% di alcool di IBA o NAA per immersione rapida può essere preparata come segue:
- Concentrazione: da 500 a 10.000 ppm;
- Durata dell’immersione della base delle talee: da 3 a 5 secondi;
- Conversione da ppm (parti per milione) a grammi.
Sebbene un'ampia gamma di piante radica molto facilmente, per cui non è importante il tipo di talea che si sceglie di fare è opportuni precisare che ne esistono di differenti tipologie. Infatti, le talee possono essere raggruppate in: talee erbacee, semilegnose e legnose, di punta, di fusto, di ramo, di foglia, di radice e tallonate. Le talee erbacee sono quelle ottenute dai rami non lignificati ed in pieno accrescimento vegetativo. Questo tipo di talee viene generalmente utilizzato sia su piante decidue che sempreverdi. Le controindicazioni riguardanti l’utilizzo di questi tipi di talea sta nel fatto che necessitano di un ambiente molto umido onde evitare un rapido disseccamento. Le talee semilegnose di piante sempreverdi vengono invece fatte in stagione più avanzata (generalmente Settembre). In questo caso il ramo impiegato si trova in una fase intermedia di maturazione e per questo viene descritto anche come legno semi-maturo o agostato. Per quanto riguarda invece le talee di tipo legnoso, queste vengono fatte in primavera e con questo metodo possono essere propagate sia specie decidue che sempreverdi. Ovviamente, maggiore è la durezza del materiale e maggiore sarà il tempo necessario per l’emissione delle radici ma di contro si riduce la sensibilità della talea all’ambiente di radicazione. Fra le tipologie di talea di più facile radicazione troviamo le talee di apice vegetativo (circa 10 cm) anche dette “talee di punta”. La facilità con cui queste radicano sta nel fatto dell’elevata presenza di auxina endogena che viene prodotta costantemente dall’apice anche dopo essere stato espiantato dalla pianta madre. Questi tipi di talea, se protette dal disseccamento, possono portare alla formazione di un buon apparato radicale già dopo 1-2 settimane. Un’altra tipologia di talea che permette la radicazione di piante più problematiche è quella tallonata. Queste talee prevedono alla base la presenza di una piccola sezione (circa 3-5 mm) del ramo dell'anno precedente. La presenza di questo tallone garantisce la possibilità di contenere livelli più alti di ormone radicante e riduce la probabilità che la base della talea vada incontro a marciume. Una pianta che si presta molto a questo tipo di talea è la Camellia sp..
Ambiente di propagazione
La cura data alle talee durante la fase critica di formazione delle radici è altrettanto importante della scelta e della preparazione del tipo di talea. Il fine di tenere in vita le talee fino alla radicazione e quindi all’auto-sostentamento ha spinto i propagatori vegetali a sviluppare molti modi creativi per fornire un ambiente favorevole alla radicazione. Luce, temperatura e umidità sono di solito i fattori ambientali maggiormente manipolati. Conoscere bene la specie su cui si sta operando è importantissimo poiché permette di determinare la preparazione dell'ambiente di propagazione. Un elevato tasso di umidità intorno alle foglie ed agli steli di talee erbacee e semilegnose di conifere e latifoglie permette di evitare il loro disseccamento e permette lo svolgimento delle normali funzioni delle piante quali fotosintesi e respirazione evitando che la pianta entri in stress mentre le nuove radici sono in formazione. Nella maggior parte dei sistemi di propagazione, si cerca di fare in modo che ci sia nel substrato di radicazione un giusto equilibrio tra aria tellurica ed umidità per consentire lo sviluppo di radici sane e per evitare eventuali marciumi. Inoltre, è stato notato che i processi biochimichi e fisiologici che portano alla radicazione delle talee si accelerano se a queste viene fornito un terreno di qualche grado più caldo rispetto alle temperature dell’aria.
Tipologie di auxine sintetiche
Prima di iniziare a parlare degli ormoni di sintesi e della loro applicazione è bene precisare che l’impiego di ormoni a concentrazioni troppo alte può essere più controproducente che il non utilizzarli affatto. I tessuti dello stelo possono essere uccisi da concentrazioni troppo alte di ormoni. Inoltre, la base della talea, una volta trattata, può anche andare incontro a necrosi dovute ad un impiego eccessivo di ormoni di sintesi e nel caso in cui la superficie di taglio dovesse necrotizzarsi non vi sarà alcun radicamento (la necrotizzazione del taglio può essere anche dovuta ad un eccesso di umidità nel substrato). Gli ormoni sintetici maggiormente utilizzati per stimolare la produzione di radici avventizie nelle talee sono l’acido indolbutirrico (IBA) e l’acido naftalenacetico (NAA). Fra i due, l’IBA è il prodotto migliore poiché promuovere la radicazione di una vastissima gamma di specie e perché nel caso in cui si dovesse eccedere con la concentrazione risulta meno fitotossico del NAA. Queste due molecole sono acquistabili in commercio sia in formulati dispersi in talco che in soluzione acquosa da diluire ulteriormente in acqua per essere portati alla concentrazione richiesta.
Metodologie di applicazione
Applicazioni polverulente
Le concentrazioni ormonali da impiegare durante la propagazione per talea devono variare in base alla tipologia di talea che si sta cercando di eseguire. Per le talee di tipo legnoso verranno utilizzate delle concentrazioni lievemente più alte di quelle impiegate per le talee di tipo erbaceo o semilegnoso. Una delle tecniche impiegate per migliorare i risultati di radicazione comprendono l’immersione della base della talea in una soluzione al 50% di acetone o di etanolo puro prima di applicare l’IBA in formato polverulento. Una volta avvenuto il trattamento ormonale è buona norma allocare la talea nel substrato di propagazione cercando di evitare che la polvere alla base delle talee venga portata via durante l’inserimento di questa nel substrato. A tal fine è preferibile fare un buco nel substrato appoggiarvi dentro la talea e rincalzarle accuratamente. Queste attenzioni vanno eseguite poiché sebbene i formulati in talco risultano essere facili da impiegare la loro forma polverulenta comporta un’elevata variabilità nella quantità di ormone che raggiunge la talea. Questo è dovuto sia alla difficoltà di adesione della polvere che alla conformazione dell’epidermide la quale può essere liscia o irregolare.
Applicazione attraverso soluzioni diluite
Un’altra tecnica impiegata per il taleaggio è quella di immergere per 24 ore, prima di inserirle nel substrato di radicazione, la parte basale della talea in una soluzione diluita di auxine [0,02 g/L (20 ppm) per le specie che radicano facilmente, 0,2 g/L (200 ppm) per quelle più ostiche]. Durante la fase di ammollo le talee devono essere mantenute in un luogo fresco (± 20°C) ed ombreggiato.
Applicazioni di soluzioni concentrate
Il metodo dell’immersione rapida in soluzione concentrata è il metodo più rapido ed efficace da impiegare per la riproduzione di piante da talee. Le soluzioni da impiegare devono essere molto concentrate (da 0,5 ad 1 grammo/litro) e devono essere preparate in una soluzione composta da una soluzione Etanolo:Acqua in rapporto 1:1. Una volta preparata la soluzione la base della talea (preferibilmente la sola superficie di taglio) vi deve essere immersa all’interno della soluzione ormonale per un periodo variabile che va dai 3 ai 10 secondi in base al tipo di talea (di meno per le erbacee di più per semi-legnose e legnose) e di specie trattata. Le talee così trattate possono essere piantate direttamente nel substrato senza particolari attenzioni. Con questo metodo si è sicuri della penetrazione uniforme degli ormoni all’interno dei tessuti vegetali ed inoltre ci sarà una ridotta influenza dei fattori ambientali sul loro assorbimento. La soluzione idroalcolica una volta preparata può essere utilizzata più e più volte per più e più giorni fino al completo esaurimento. L’unica precauzione da prendere è quella di assicurarsi di chiudere ermeticamente il contenitore per evitare l’evaporazione dell’alcool e quindi la successiva concentrazione degli ormoni. Nel caso in cui si dovessero osservare dei fenomeni di fitotossicità quali l’inibizione dello sviluppo delle gemme, la necrotizzazione del fusto o l’ingiallimento fogliare, potrebbe voler significare che sono state utilizzate concentrazioni ormonali troppo alte. Se la concentrazione ormonale utilizzata è corretta si dovrebbe invece osservare in breve tempo un lieve ingrossamento della base della talea dovuta alla produzione di callo.
La soluzione concentrata al 50% di alcool di IBA o NAA per immersione rapida può essere preparata come segue:
- Concentrazione: da 500 a 10.000 ppm;
- Durata dell’immersione della base delle talee: da 3 a 5 secondi;
- Conversione da ppm (parti per milione) a grammi.
PPM | MG | G |
|---|---|---|
500 | 500 | 0,5 |
1000 | 1000 | 1 |
5000 | 5000 | 5 |
10000 | 10000 | 10 |
Auxine per litro di soluzione
Per fare una soluzione madre a 10.000 ppm (10 g/L) bisogna proseguire come segue. Sciogliere 10 g di auxine in 15-20 ml di alcool etilico puro, una volta ottenuta la completa solubilizzazione dell’ormone bisogna portare la soluzione a volume di 1 litro utilizzando una soluzione acqua distillata:alcool al 50%.
Metodi alternativi di applicazione
Esistono anche dei metodi alternativi di applicazione delle auxine e fra questi possiamo ricordare la polverizzazione di una soluzione concentrata sulla superficie di taglio o sulle foglie della talea, l’immersione della talea intera in soluzione concentrata, l’applicazione di auxine sulle piante madri prima di prelevare le talee ed infine un metodo degno di essere menzionato riguarda l’applicazione dei cristalli di IBA tramite nastro adesivo. Questo è un metodo molto efficace che permette di ottenere degli ottimi risultati. Inizialmente L’IBA viene disciolto in acetone ed una volta solubilizzato viene lasciato evaporare all’interno di un piatto. Una volta che l’acetone è completamente evaporato sarà possibile notare sul piatto la formazione di cristalli. Questi cristalli verranno fatti aderire sulla superficie di un nastro di PVC nero. Il PVC verrà così avvolto intorno al ramo nel punto che si desidererà tagliare (è preferibile creare delle piccole abrasioni intorno al ramo per favorire la radicazione) e lasciato agire per più di una settimana. La mancanza di luce e l’ormone indurranno così l’inizializzazione radicale, prima ancora che la talea venga rimossa dalla pianta madre.
Ormoni fatti in casa
Uno dei metodi più antichi ed efficaci per far radicare le talee è quello dell’impiego dell’estratto acquoso del salice anche noto col nome di “Willow Water”. L’efficacia di questo estratto è dovuto a due molecole in particolare: l’auxina e l’acido salicilico. Il salice è una pianta ricca in acido salicilico e tale acido altri non è che un ormone ubiquitario che svolge un ruolo fondamentale nella difesa della pianta contro i patogeni fungendo da molecola segnale (avvisa la pianta di un eventuale attacco stimolando il sistema immunitario della pianta stessa). Per la preparazione della “Willow Water” basta recuperare gli apici vegetativi del salice che sono ricchi in auxine ed alcuni rami lignificati ricchi in acido salicilico. Una volta deprivati delle foglie questi vengono immersi in acqua bollente e ne viene fatto un infuso. Una volta raffreddato l’infuso viene filtrato e conservato in frigo per un periodo non superiore ad 1-2 mesi. Le talee vengono trattate lasciando la base immersa in questo estratto per circa 8 ore. La ricetta per la preparazione è abbastanza empirica e prevede l’utilizzo di una tazza di rametti defogliati da estrarre in 2 litri di acqua bollente.
Alcune informazioni riguardanti il paragrafo 2 (escluso “ormoni fatti in casa) sono state prese da “Plant Propagation - Principles and practices”, H.T. Hartmann, D.E.Kester, F.T. Davies
Metodi alternativi di applicazione
Esistono anche dei metodi alternativi di applicazione delle auxine e fra questi possiamo ricordare la polverizzazione di una soluzione concentrata sulla superficie di taglio o sulle foglie della talea, l’immersione della talea intera in soluzione concentrata, l’applicazione di auxine sulle piante madri prima di prelevare le talee ed infine un metodo degno di essere menzionato riguarda l’applicazione dei cristalli di IBA tramite nastro adesivo. Questo è un metodo molto efficace che permette di ottenere degli ottimi risultati. Inizialmente L’IBA viene disciolto in acetone ed una volta solubilizzato viene lasciato evaporare all’interno di un piatto. Una volta che l’acetone è completamente evaporato sarà possibile notare sul piatto la formazione di cristalli. Questi cristalli verranno fatti aderire sulla superficie di un nastro di PVC nero. Il PVC verrà così avvolto intorno al ramo nel punto che si desidererà tagliare (è preferibile creare delle piccole abrasioni intorno al ramo per favorire la radicazione) e lasciato agire per più di una settimana. La mancanza di luce e l’ormone indurranno così l’inizializzazione radicale, prima ancora che la talea venga rimossa dalla pianta madre.
Ormoni fatti in casa
Uno dei metodi più antichi ed efficaci per far radicare le talee è quello dell’impiego dell’estratto acquoso del salice anche noto col nome di “Willow Water”. L’efficacia di questo estratto è dovuto a due molecole in particolare: l’auxina e l’acido salicilico. Il salice è una pianta ricca in acido salicilico e tale acido altri non è che un ormone ubiquitario che svolge un ruolo fondamentale nella difesa della pianta contro i patogeni fungendo da molecola segnale (avvisa la pianta di un eventuale attacco stimolando il sistema immunitario della pianta stessa). Per la preparazione della “Willow Water” basta recuperare gli apici vegetativi del salice che sono ricchi in auxine ed alcuni rami lignificati ricchi in acido salicilico. Una volta deprivati delle foglie questi vengono immersi in acqua bollente e ne viene fatto un infuso. Una volta raffreddato l’infuso viene filtrato e conservato in frigo per un periodo non superiore ad 1-2 mesi. Le talee vengono trattate lasciando la base immersa in questo estratto per circa 8 ore. La ricetta per la preparazione è abbastanza empirica e prevede l’utilizzo di una tazza di rametti defogliati da estrarre in 2 litri di acqua bollente.
Alcune informazioni riguardanti il paragrafo 2 (escluso “ormoni fatti in casa) sono state prese da “Plant Propagation - Principles and practices”, H.T. Hartmann, D.E.Kester, F.T. Davies